PROCESOS TERMODINÁMICOS
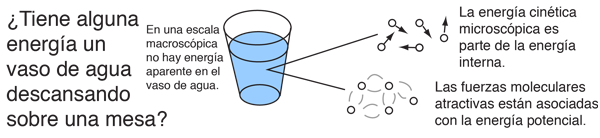
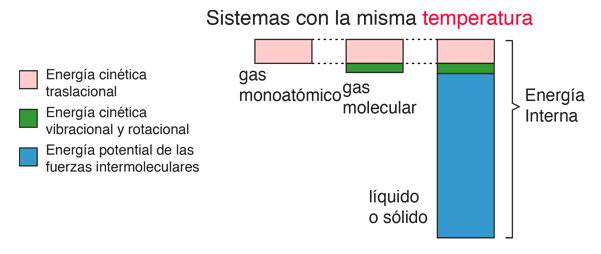
En física, se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema termodinámico. Desde el punto de vista de la termodinámica, estas transformaciones deben transcurrir desde un estado de equilibrio inicial a otro final; es decir, que las magnitudes que sufren una variación al pasar de un estado a otro deben estar perfectamente definidas en dichos estados inicial y final. De esta forma los procesos termodinámicos pueden ser interpretados como el resultado de la interacción de un sistema con otro tras ser eliminada alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren en equilibrio (mecánico, térmico y/o material) entre sí.
De una manera menos abstracta, un proceso termodinámico puede ser visto como los cambios de un sistema, desde unas condiciones iniciales hasta otras condiciones finales, debido a su des-estabilización.
Procesos termodinámicos.
Proceso adiabático.
Se designa como proceso adiabático a aquel en el cual el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isentrópico.
El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la temperatura adiabática de una llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar de que se consiga variar la temperatura del aire y su humedad relativa.
Durante un proceso adiabático, la energía interna del fluido que realiza el trabajo debe necesariamente decrecer.
Es decir, que en este tipo de procesos se tiene que Q = 0. Que de acuerdo con la primera ley de la termodinámica, tenemos que:
Q= ∆U +W
Como Q =0, entonces, ∆U = -W.
Esto quiere decir, que para un gas contenido en un cilindro provisto de un pistón, cuyas paredes no permiten la transferencia de calor al exterior, la variación de energía interna es igual al trabajo, ya sea realizado por el sistema o sobre el sistema.
Proceso isotérmico.
En este proceso la temperatura permanece constante. Como la energía interna de una gas ideal sólo es función de la temperatura, en un proceso isotérmico de un gas ideal la variación de la energía interna es cero (∆U= 0) La curva hiperbólica se conoce como isotérmica.
De acuerdo con la primera ley de la termodinámica tenemos:
Q = ∆U +W.
Como ∆U = 0, entonces, Q = W
Este proceso se observa cuando en un pistón que contiene un gas, después de suministrarle calor y producir cambios tanto en la presión como en el volumen su temperatura permanece constante.
Proceso isobárico.
Es un proceso termodinámico en el cual la presión permanece constante, en este proceso, como la presión se mantiene constante, se produce una variación en el volumen y por tanto el sistema realiza trabajo o se puede realizar trabajo sobre el sistema.
De acuerdo con la primera ley de la termodinámica, tenemos:
Q = ∆U +W
Lo que quiere decir que en un proceso de tipo isobárico tanto el calor transferido como el trabajo realizado ocasionan una variación de la energía interna.
Proceso isométrico
En este proceso el volumen permanece constante, es decir que en este tipo de proceso el volumen no varía y por tanto el trabajo es igual a cero, lo que significa queW= 0.
De acuerdo con la primera ley de la termodinámica tenemos:
Q = ∆U +W
Como W=0, entonces Q = ∆U
Ejemplos.
1. Sobre un gas contenido en un cilindro provisto de un pistón se realiza un trabajo de 5000 J, mediante un proceso isotérmico. Determinar:
a. La variación de la energía interna del gas.
b. El calor absorbido o cedido por el gas.
Solución:
a. Puesto que el proceso es isotérmico, se tiene que ∆U = 0, luego la energía interna no varía.
b. Como el trabajo se realiza sobre el gas W = -5000 J, por tanto,
Q = ∆U + W
Q =0 – 5000J
Q = -5000J
Puesto que el calor es negativo, concluimos que el gas cede calor y su valor es 5000J.
2. En la figura, se muestra un diagrama P-V en el que se representan dos procesos A y B, a los que se somete un gas para pasar del estado 1 al estado 2. Determinar:
a. Las variables en los estados 2 y 3.
b. El proceso en el que se realiza mayor trabajo sobre el gas.
c. El proceso en el que es mayor el incremento de la energía interna.
d. El proceso en el que el sistema absorbe más calor.
TRANSMISIÓN DE CALOR
El calor se transmite de un lugar a otro de tres maneras diferentes:
- Por conducción entre cuerpo sólidos en contacto
- Por convección en fluidos (líquidos o gases)
- Por radiación a través del medio en que la radiación pueda propagarse
Ejemplo 1
Placa solar
El calor llega desde el Sol hasta la placa metálica por radiación. El metal de la
placa emite radiación en el infrarrojo
|
|
.
El calor se transmite al líquido que está en contacto con la placa por conducción.
En el líquido se establecen corrientes covectivas que lo
mezclan y uniformizan el calor. El agua caliente sube y la fría baja.
El agua más caliente sube al depósito superior y de la parte inferior de este
depósito baja el agua más fría que entra por la parte de abajo de la placa
|
Con esta sencilla placa, y dependiendo de la radiación solar, se
alcanzan temperaturas muy altas. Probablemente hayas visto estas placas en los
tejados de algunas casas. Busca en la red "placas solares"